Bảng nguyên tố hóa học
1. Ý nghĩa của bảng tuần hoàn hóa học
Bảng tuần hoàn hóa học là công cụ quan trọng giúp học sinh lớp 8 hệ thống hóa kiến thức về các nguyên tố. Thông qua bảng tuần hoàn hóa học, người học biết được ký hiệu hóa học, tên nguyên tố, nguyên tử khối tương đối và số hiệu nguyên tử. Từ đó, bảng tuần hoàn hóa học giúp so sánh tính chất, dự đoán khả năng phản ứng và mối liên hệ giữa các nguyên tố trong hóa học cơ bản.
2. Vai trò của bảng tuần hoàn hóa học trong học tập
Trong chương trình lớp 8, bảng nguyên tố hóa học hỗ trợ học sinh ghi nhớ nguyên tố dễ hơn, hiểu quy luật sắp xếp các nguyên tố và làm nền tảng để học các khái niệm như đơn chất, hợp chất, phản ứng hóa học. Nhờ bảng tuần hoàn hóa học, việc tra cứu và học tập trở nên trực quan, logic và khoa học hơn.
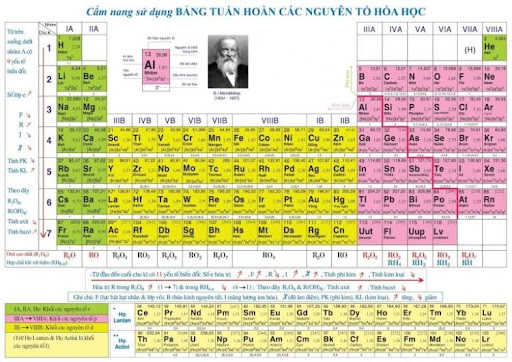
Bảng tuần hoàn hóa học - bản tiếng Việt
3. Xuất xứ của bảng tuần hoàn hóa học
Bảng tuần hoàn hóa học do nhà khoa học người Nga Dmitri Ivanovich Mendeleev xây dựng lần đầu vào năm 1869. Ông sắp xếp các nguyên tố theo nguyên tử khối và phát hiện ra tính tuần hoàn trong tính chất của chúng. Phát minh này đặt nền móng cho bảng tuần hoàn hóa học hiện đại và trở thành một trong những thành tựu quan trọng nhất của hóa học.
4. Ý nghĩa lịch sử và khoa học
Sự ra đời của bảng tuần hoàn hóa học không chỉ giúp con người hiểu rõ hơn về cấu tạo vật chất mà còn thúc đẩy sự phát triển của khoa học, công nghiệp và đời sống. Đến nay, bảng nguyên tố hóa học vẫn được sử dụng rộng rãi trong giảng dạy và nghiên cứu, đặc biệt là ở bậc học cơ sở như lớp 8
Trong bảng tuần hoàn hóa học, mỗi nguyên tố đều được thể hiện bằng nhiều số liệu và ký hiệu khác nhau. Các thông tin này giúp học sinh lớp 8 nhận biết nguyên tố, hiểu cấu tạo nguyên tử và vận dụng vào việc học hóa học cơ bản.
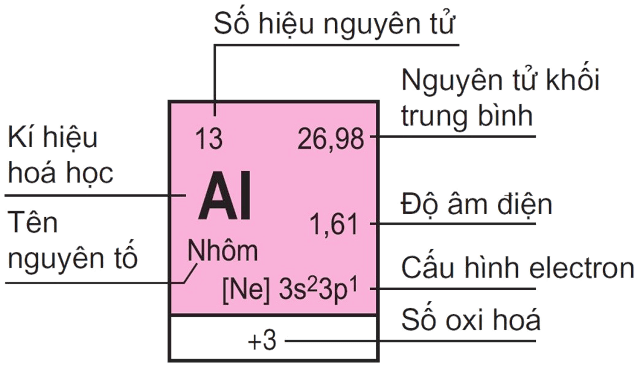
Phân tích các dữ kiện trong bảng tuần hoàn hóa học
1. Số hiệu nguyên tử
Số hiệu nguyên tử trong bảng tuần hoàn hóa học cho biết số proton có trong hạt nhân nguyên tử. Đối với nguyên tử trung hòa, số proton cũng chính là số electron. Nhờ số hiệu nguyên tử, ta xác định chính xác một nguyên tố và phân biệt nó với các nguyên tố khác.
Ví dụ: Nguyên tố clo có số hiệu nguyên tử là 17, điều đó có nghĩa là trong nguyên tử clo có 17 proton và 17 electron. Dù clo tồn tại ở nhiều dạng khác nhau, số hiệu nguyên tử 17 luôn không thay đổi.
2. Nguyên tử khối
Nguyên tử khối là số đo khối lượng tương đối của nguyên tử, được so sánh với nguyên tử cacbon. Trong bảng tuần hoàn hóa học, nguyên tử khối giúp học sinh tính toán khối lượng chất tham gia và tạo thành trong phản ứng hóa học.
Ví dụ: Canxi có nguyên tử khối là 40. Khi tính toán, ta hiểu rằng 1 mol canxi có khối lượng 40 gam, từ đó dễ dàng giải các bài toán về khối lượng và số mol.
3. Ký hiệu hóa học
Ký hiệu hóa học là cách viết ngắn gọn tên nguyên tố trong bảng tuần hoàn hóa học, thường gồm một chữ cái hoặc một chữ cái viết hoa kèm chữ cái viết thường. Ký hiệu này được sử dụng phổ biến trong công thức và phương trình hóa học.
Ví dụ: Ký hiệu của magie là Mg. Khi kết hợp với oxi, ta viết được công thức của oxit magie là MgO, trong đó Mg đại diện cho nguyên tố magie trong bảng nguyên tố hóa học.
4. Tên nguyên tố
Tên nguyên tố trong bảng tuần hoàn hóa học giúp người học gọi đúng và phân biệt các nguyên tố với nhau. Mỗi nguyên tố có tên riêng, gắn liền với tính chất và vai trò của nó trong đời sống và khoa học.
Ví dụ: Hiđro là nguyên tố nhẹ nhất, còn sắt là kim loại quen thuộc dùng trong xây dựng. Nhờ tên nguyên tố, ta dễ dàng liên hệ kiến thức hóa học với các vật dụng và hiện tượng trong thực tế.
5. Mối liên hệ giữa các số liệu trong bảng tuần hoàn hóa học
Các số liệu trong bảng tuần hoàn hóa học có mối liên hệ chặt chẽ với nhau, giúp người học suy ra nhiều thông tin quan trọng về nguyên tố. Khi biết số hiệu nguyên tử, nguyên tử khối và ký hiệu hóa học, ta có thể hiểu cơ bản về cấu tạo và khả năng tham gia phản ứng của nguyên tố đó.
Ví dụ: Nhôm có số hiệu nguyên tử là 13 và nguyên tử khối là 27. Từ đó, ta biết nhôm có 13 proton, 13 electron và thường tham gia phản ứng với oxi tạo thành hợp chất nhôm oxit, được ứng dụng rộng rãi trong thực tế.
Học thuộc bảng tuần hoàn hóa học là yêu cầu cơ bản trong chương trình Hóa học lớp 8. Nếu học đúng cách, học sinh không cần ghi nhớ máy móc mà vẫn nhớ lâu, hiểu bản chất và vận dụng tốt khi làm bài.
1. Hiểu ý nghĩa trước khi học thuộc bảng tuần hoàn hóa học
Trước khi học thuộc bảng tuần hoàn hóa học, cần hiểu bảng này dùng để làm gì. Bảng tuần hoàn hóa học giúp nhận biết nguyên tố, biết số hiệu nguyên tử, nguyên tử khối và ký hiệu hóa học. Khi hiểu rõ ý nghĩa, việc ghi nhớ sẽ nhẹ nhàng hơn rất nhiều.
Ví dụ: Khi biết số hiệu nguyên tử cho biết số proton và electron, học sinh sẽ nhớ số hiệu không còn là con số vô nghĩa.
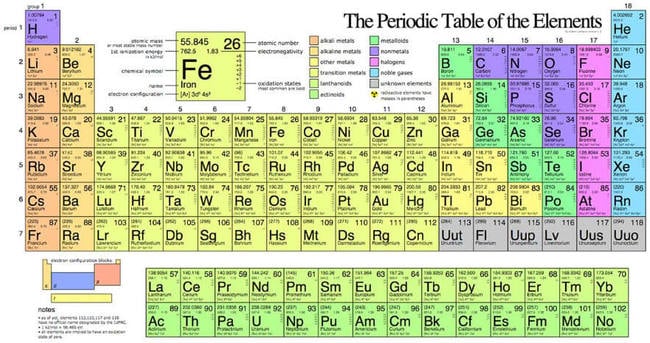
Bảng tuần hoàn hóa học - bản tiếng Anh
2. Học bảng tuần hoàn hóa học theo nhóm nguyên tố quen thuộc
Không nên học thuộc bảng tuần hoàn hóa học một cách rời rạc từng nguyên tố. Hãy chia các nguyên tố thành nhóm quen thuộc như kim loại, phi kim hoặc các nguyên tố thường gặp trong đời sống.
Ví dụ: Hiđro, oxi, cacbon, nitơ là những nguyên tố xuất hiện nhiều trong không khí và nước, nên học nhóm này trước sẽ dễ nhớ hơn.
3. Ghi nhớ bảng tuần hoàn hóa học qua ví dụ và chất quen thuộc
Liên hệ bảng tuần hoàn hóa học với các chất quen thuộc giúp não bộ ghi nhớ lâu hơn.
Ví dụ: Nước có công thức H₂O, từ đó nhớ được ký hiệu của hiđro là H và oxi là O. Muối ăn là NaCl, giúp nhớ natri (Na) và clo (Cl) trong bảng tuần hoàn hóa học.
4. Học bảng tuần hoàn hóa học theo số hiệu nguyên tử nhỏ trước
Nên bắt đầu học bảng tuần hoàn hóa học từ các nguyên tố có số hiệu nguyên tử nhỏ, vì đây là những nguyên tố xuất hiện nhiều trong chương trình lớp 8.
Ví dụ: Học chắc các nguyên tố từ hiđro đến canxi trước, sau đó mới mở rộng sang các nguyên tố khác để tránh quá tải kiến thức.
5. Viết lại bảng tuần hoàn hóa học bằng tay
Việc tự tay ghi lại thông tin từ bảng tuần hoàn hóa học giúp tăng khả năng ghi nhớ. Khi viết, não bộ sẽ xử lý thông tin sâu hơn so với chỉ nhìn hoặc đọc.
Ví dụ: Mỗi ngày viết lại 5– 7 nguyên tố gồm tên, ký hiệu và số hiệu nguyên tử sẽ giúp nhớ bền hơn sau vài ngày.
6. Ôn lại bảng nguyên tố hóa học theo chu kỳ
Học thuộc bảng tuần hoàn hóa học cần được ôn tập đều đặn. Không nên học một lần rồi bỏ.
Ví dụ: Sau khi học xong hôm nay, ôn lại vào ngày hôm sau và một tuần sau để củng cố trí nhớ dài hạn.
7. Kết hợp bảng tuần hoàn hóa học với bài tập
Làm bài tập có sử dụng bảng tuần hoàn hóa học là cách học rất hiệu quả. Khi thường xuyên tra cứu và dùng đến, học sinh sẽ tự nhiên nhớ mà không cần học vẹt.
Ví dụ: Khi làm bài tính khối lượng chất, phải dùng nguyên tử khối trong bảng nguyên tố hóa học, lâu dần sẽ nhớ các số liệu quen thuộc.
Trong quá trình học hóa học lớp 8, không cần ghi nhớ toàn bộ bảng tuần hoàn hóa học ngay từ đầu, nhưng có một số nguyên tố đặc biệt xuất hiện rất thường xuyên, có vai trò quan trọng và dễ gây nhầm lẫn. Những nguyên tố này cần được lưu ý kỹ để học tốt phần kiến thức nền tảng.
1. Hiđro (H)
Hiđro là nguyên tố nhẹ nhất trong bảng tuần hoàn hóa học và có nhiều tính chất đặc biệt. Hiđro vừa có thể thể hiện tính kim loại, vừa có thể thể hiện tính phi kim trong một số phản ứng.
Ví dụ: Hiđro tham gia tạo nước (H₂O) và nhiều hợp chất quan trọng khác, nên xuất hiện rất nhiều trong bài học và bài tập.
2. Oxi (O)
Oxi là nguyên tố phi kim hoạt động mạnh và giữ vai trò quan trọng trong bảng tuần hoàn hóa học. Oxi tham gia vào nhiều phản ứng hóa học, đặc biệt là phản ứng oxi hóa.
Ví dụ: Sự cháy thực chất là quá trình các chất phản ứng với oxi, vì vậy oxi luôn được nhắc đến trong các bài học cơ bản.
3. Cacbon (C)
Cacbon là nguyên tố trung tâm của hóa học hữu cơ và có vị trí đặc biệt trong bảng tuần hoàn hóa học.
Ví dụ: Than, kim cương đều là các dạng tồn tại khác nhau của cacbon. Ngoài ra, cacbon còn tham gia tạo CO₂, một chất quen thuộc trong đời sống.
4. Natri (Na)
Natri là kim loại hoạt động hóa học rất mạnh trong bảng tuần hoàn hóa học, dễ phản ứng với nước và không khí.
Ví dụ: Natri có trong muối ăn (NaCl), nhưng ngoài tự nhiên natri không tồn tại ở dạng đơn chất mà thường ở dạng hợp chất.
5. Clo (Cl)
Clo là nguyên tố phi kim có tính hoạt động mạnh, thường tham gia phản ứng với kim loại tạo muối.
Ví dụ: Clo kết hợp với natri tạo thành muối ăn NaCl, một ví dụ điển hình thường gặp khi học bảng tuần hoàn hóa học.
6. Sắt (Fe)
Sắt là kim loại quen thuộc, xuất hiện rất nhiều trong thực tế và trong bảng tuần hoàn hóa học.
Ví dụ: Sắt dễ bị oxi hóa trong không khí ẩm tạo thành gỉ sắt, đây là hiện tượng thường được dùng để minh họa phản ứng hóa học.
7. Nhôm (Al)
Nhôm là kim loại nhẹ, có khả năng phản ứng với oxi tạo lớp oxit bảo vệ bên ngoài. Đây là điểm đặc biệt khiến nhôm ít bị ăn mòn hơn so với nhiều kim loại khác.
Ví dụ: Nhôm được dùng nhiều trong sản xuất đồ gia dụng nhờ tính bền và nhẹ.